一、CRO行业基本概述
(一)行业定义
合同研究组织(Contract Research Organization, CRO)20世纪80年代初起源于美国,它是通过合同形式为制药企业、医疗机构、中小医药医疗器械研发企业、甚至各种政府基金等机构在基础医学和临床医学研发过程中提供专业化服务的一种学术性或商业性的科学机构。
(二)行业分类
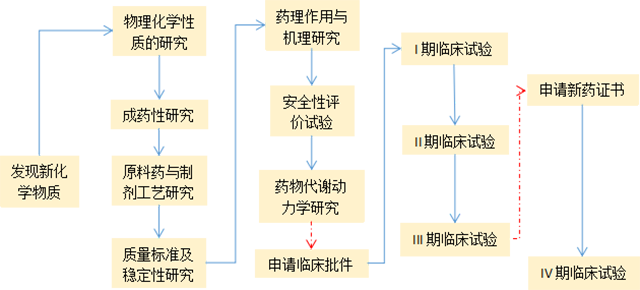
按照工作的性质,CRO主要分为临床前研究(Pre-Clinical)CRO和临床研究CRO。临床前研究阶段包含物理化学性质的研究等,临床研究阶段包含I期临床试验等,具体可参考新药研发流程(如图1)。
图1 新药研发流程
二、CRO行业政策
(一)行业监管体制
为加强药品监督管理,保证药品质量,保障人民用药安全,维护人民身体健康和用药的合法权益,国家对药品的研制、生产、监督管理等方面制定了一系列制度。
1.药品生产许可制度
开办药品生产企业,须经企业所在地省、自治区、直辖市人民政府药品监督管理部门批准并发给《药品生产许可证》。无《药品生产许可证》的,不得生产药品。《药品生产许可证》应当标明有效期和生产范围,到期重新审查发证。
2.药品注册制度
生产新药或者已有国家标准药品的,须经国务院药品监督管理部门批准,并发给药品批准文号。药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请。药品生产企业在取得药品批准文号后,方可生产该药品。
3.药品生产质量管理制度
为规范药品生产质量管理,企业应当建立药品质量管理体系,该体系应当涵盖影响药品质量的所有因素,包括确保药品质量符合预定用途的有组织、有计划的全部活动。
(二)行业政策
表1 行业政策
|
临床试验技术指导相关文件
|
|||
|
发布日期 |
技术指导文件 |
颁发部门 |
主要内容 |
|
2016.7 |
《临床试验的电子数据采集技术指导原则》 |
CFDA |
电子数据采集系统的基本技术要求以及在临床试验实施不同阶段的应用要求的详细阐述。 |
|
《临床试验数据管理工作技术指南》 |
CFDA |
明确数据管理相关责任人的职责,阐述数据管理员培训内容的资质认证,临床试验数据管理系统的建立和基本要求。 |
|
|
《药物临床试验数据管理与统计分析的计划和报告指导原则》 |
CFDA |
明确了数据管理计划基本内容、数据核查和盲审、数据管理报告的基本内容,详细描述统计分析计划的基本内容。 |
|
|
2016.7 |
《关于开展仿制药质量和疗效一致性评价培训的通知》 |
CFDA |
指导一致性评价中临床试验开展 |
|
2016.6 |
《药物临床试验的生物统计学指导原则》 |
CFDA |
临床试验中生物统计的基本要求和指导 |
|
2016.5 |
186种品种BE试验指导意见草案 |
中检院 |
药品生物等药性试验技术指导 |
表2 行业政策
| 仿药一致性评价政策法规和技术指导日趋完善 | |||
|
发布时间 |
条款 |
发布机构 |
类别 |
|
2015.10 |
《普通口服固体制剂参比制剂选择和确定指导原则(征求意见稿)》 《普通口服固体制剂溶出曲线测定与比较指导原则(征求意见稿)》 《仿制药质量一致性评价人体生物等效性研究技术指导原则(征求意见稿)》 |
CFDA |
业务指导 |
|
2015.12 |
《关于化学药生物等效性试验实行备案管理的公告》 |
CFDA |
政策法规 |
|
2016.3 |
《关于开展仿制药质量和疗效一致性评价的意见》 |
国务院 |
政策法规 |
|
2016.3 |
《普通口服固体制剂参比制剂选择和确定等3个技术指导原则的公告》 |
CFDA |
业务指导 |
|
2016.3 |
《公开征求药物溶出仅机械验证指导原则的意见》 |
CFDA |
业务指导 |
|
2016.3 |
《公开征求仿制药质量和疗效一致性评价工作程序及化学药品仿制药口服固体制剂一致性评价申报资料要求意见》 |
CFDA |
政策法规 |
|
2016.4 |
《公开征求人体生物等效性试验豁免指导原则的意见》 |
CFDA |
政策法规 |
|
2016.4 |
《公开征求仿制药质量和疗效一致性评价参比制剂备案与推荐程序的意见》 |
CFDA |
政策法规 |
|
2016.4 |
《药物溶出度仅机械验证指导原则的通告》 |
CFDA |
业务指导 |
|
2016.5 |
《药物临床试验机构资格认定服务指南》 |
CFDA |
政策法规 |
表3 行业政策
|
药品注册管理办法中关于临床试验基地的政策变动
|
|
|
概述 |
《药品注册管理办法(修订稿)》(2016) |
|
修改稿对GLP和GCP的机构要求描述不同 |
第三十四条“药物临床前安全性评价研究应当符合《药物非临床研究质量管理规范》(GLP)的要求,在通过GLP认证的机构开展。临床试验应当执行《药物临床试验质量管理规范》(GCP),在符合临床试验管理要求的机构开展。临床试验用药品的制备必须符合《药品生产质量管理规范》(GMP)。” |
|
评估方发生变化 |
第三十六条“申请人应当对承担临床试验的机构和研究人员进行评估,以保证满足临床试验的要求和受试者的保护。” |
三、CRO行业发展现状和特点
从市场全球分布上来看,目前,美国和欧洲占据了CRO市场的绝大部分份额,分别约占全球的46%与25%,但随着新兴国家医药事业的发展与全球产业转移的趋势,未来几年CRO行业发展热点将从以欧美为代表的发达国家逐渐向以中国为代表的发展中国家转移。
1996年,MDS Pharma Service在我国投资设立了中国第一家真正意义上的CRO,从事新药的临床试验业务,标志着我国CRO行业正式开启。1998年我国仿照美国食品药品监督管理局的形式所成立的SFDA,制定颁布了一系列药品管理法规,强化药品审查制度,我国的药品监督管理体系逐步完善,客观上促进了我国CRO行业的快速发展。
目前,我国CRO企业主要通过向各类药企提供新药研发外包服务;与药物非临床研究机构合作进行新药临床前研究,同时制定合理的研究方案;统一协调药物临床试验机构临床试验并处理分析试验数据,最后向药企提供研究结果并协助进行新药注册申报。
四、CRO市场业务格局
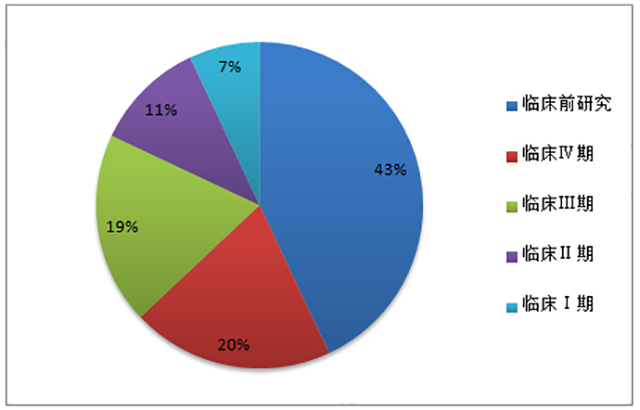
据美国临床试验数据库等数据来源显示,2014年全球 CRO 市场收入约 70%来自临床市场。其中,临床Ⅱ和临床Ⅲ期占了全部收入的 50%左右。我国CRO市场临床研究占到近60%。其中,临床I至III期市场合计约 37%,占比相对较低,且服务水平尚有一定提升空间。近年来,随着国内大中型 CRO 企业在临床试验领域与跨国药企开展合作,积累了越来越多的优质客户和临床试验研究经验,服务水平也正在快速提高,并逐步向国际先进水平靠拢。
图2 全球CRO 市场业务格局
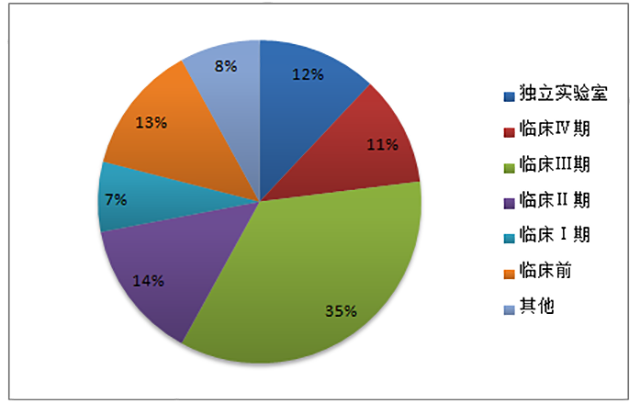
图3 中国CRO 市场业务格局
五、CRO行业重点上市公司研究与分析
根据2016年年底数据(见表4)显示,净利润、营业收入、净资产收益率、毛利率均为正数,两家公司净利润同比为负数,一家营业收入同比为负数。
表4 CRO行业重点上市公司财务指标(20161231)
|
公司 |
净利润(元) |
净利润同比(%) |
营业收入(元) |
营业收入同比(%) |
净资产收益率(%) |
毛利率(%) |
|
泰格医药 |
1.41亿 |
-10.00 |
11.75亿 |
22.73 |
9.34 |
38.03 |
|
博济医药 |
208.71万 |
-91.87 |
7,215.15万 |
-43.02 |
0.48 |
48.66
|
|
华大基因 |
3.33亿 |
26.93 |
17.11亿 |
29.79
|
10.38 |
58.44 |
截至2017年7月17日,6个月以内共有 17 家机构对泰格医药的2017年度业绩作出预测;预测2017年每股收益 0.54 元,较去年同比增长 80%,预测2017年净利润 2.68 亿元,较去年同比增长 90.4% 。
图4泰格医药业绩预测

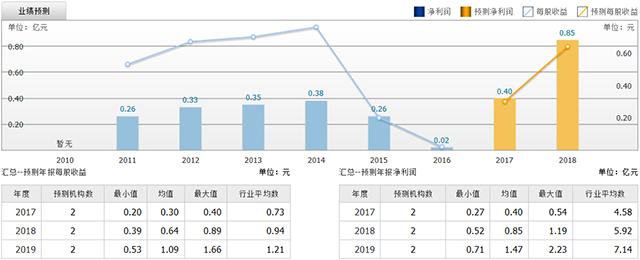
截至2017年7月17日,6个月以内共有 2 家机构对博济医药的2017年度业绩作出预测;预测2017年每股收益 0.30 元,较去年同比增长 1810.83%,预测2017年净利润 0.40 亿元,较去年同比增长 1832.84%。
图5博济医药业绩预测
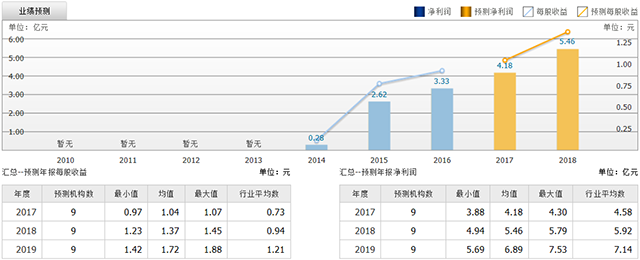
截至2017年7月17日,6个月以内共有 9 家机构对华大基因的2017年度业绩作出预测;预测2017年每股收益 1.04 元,较去年同比增长 13.04%,预测2017年净利润 4.18 亿元,较去年同比增长 25.53%。
图6华大基因业绩预测
六、CRO行业发展趋势
(一)行业驱动因素
因素1:专利大规模到期
因素2:研发成本大幅度升高
因素3:研发成功率大幅度降低
根据Evaluate Phama的统计,药品专利悬崖将在2016-2020年间造成全球药企790亿美元的销售额损失,使得制药企业迫切需要加快研发速度与缩短新药获批时间;医药企业迫切需要节省研发时间和研发成本,而CRO作为专业的研发外包机构,可以提供更加专业化的研发服务,据不完全统计,CRO研发行业可缩短普通研发时间的30%,部分外包协议甚至可以降低研发成本的40%;随着药品需求转型、行业竞争越来越激烈,相较于以前,药品研发难度升级,研发成功率也大幅度降低,促进了CRO行业专业化分工的发展。
(二)行业发展趋势
第一,行业运营门槛将越来越高,行业集中度不断上升。CRO 行业作为新药研发价值链中的重要环节,在质量标准体系上不可避免地要与制药行业严格的行业标准接轨。近年来,我国对药物研发过程的质量管理标准日益提高,逐渐向西方发达国家的质量标准体系靠拢。愈发严苛的质量标准将会迫使CRO 公司加大软硬件投入,增加CRO 公司的运营成本,小型CRO 公司可能面临被淘汰的局面,而具有一定规模的CRO 公司将会赢得更大的市场份额。
第二,CRO 行业纵向一体化的发展趋势。新药研发是一个系统工程,对应的CRO 服务类型也覆盖了药物发现阶段、临床前研究、临床研究、新药注册申报服务等多个环节,不同环节对应的技术难度不同,可获得的附加值也高低有别。业务单一的CRO 公司无法满足制药企业多方面的需求,难以提升客户忠诚度。由于纵向一体化不仅能为客户提供更便捷的一站式服务,也是构建自身竞争力、提升盈利能力的有效途径,因此通过连通上下游环节、拓展业务范围从而实现纵向一体化,正成为CRO 行业新的趋势。目前,国际大型CRO 公司大多有能力提供一站式全流程服务,但我国CRO 公司中能够提供一站式全流程服务的仍然屈指可数。对于我国的CRO 公司来说,打造完整的产业服务链可以提高我国医药行业的技术创新能力,满足其对CRO 服务日益增长的需求。
第三,自主创新将日益成为CRO 公司的核心竞争力。CRO 行业是随着药物研发而衍生出的行业,而医药研发走上了自主创新的道路,必将对提供研发外包服务的CRO 公司提出更高的要求,促使CRO 行业走上自主创新的道路。
第四,全球医药研发活动向我国及其他低成本国家转移。近年来,全球范围内,新药研发的平均投入不断加大,由此带动了CRO 行业市场规模的不断扩容。同发达国家相比,我国具有相关人才密集、人力成本和原材料成本低廉等显著优势,在我国开展新药研发可以显著降低研发成本。所以,国际大型制药企业陆续在我国建立了研发中心,将大量的新药研发工作放在中国进行,这无疑给我国CRO 行业提供了更多的机会。与此同时,国际大型CRO 公司纷纷以合资或并购的形式进入中国市场,CRO 公司如何应对国际同行的挑战,如何提升自身实力以参与国际竞争,成为我国CRO 公司不可回避的问题。